ЦПД — это… Что такое ЦПД?
ЦПД — центр приёма данных Словарь: С. Фадеев. Словарь сокращений современного русского языка. С. Пб.: Политехника, 1997. 527 с. ЦПД центр психологической диагностики мед. ЦПД церебральное перфузионное давление мед … Словарь сокращений и аббревиатур
ЦПД — центр приёма данных цитопатогенное действие … Словарь сокращений русского языка
Отёк мозга — Отёк вещества головного мозга (тёмный участок) вокруг метаст … Википедия
Церебральное перфузионное давление — (сокращенно ЦПД) физиологический показатель характеризует уровень перфузии (кровоснабжения) головного мозга живых существ. Относится к одному из основных показателей нейромониторинга ЦПД определяется по формуле: ЦПД = среднее артериальное… … Википедия
Простой герпес — Простой герпес … Википедия
Гиперосмолярные растворы в комплексе лечения больных с внутричерепными кровоизлияниями
Вирусные инфекции — инфекции (см. Инфекция) животных, включая человека, растений и бактерий, вызываемые вирусами. Общие закономерности этиологии, патогенеза, клиники, эпидемиологии В. и. такие же, как инфекций, вызванных бактериями, грибами и простейшими. Главные… … Словарь микробиологии
цифровая подпись — ЦПД Данные, добавленные к блоку данных, или криптографическое преобразование блока данных, которое позволяет получателю данных удостовериться в происхождении и целостности блока данных и обеспечить защиту от мошенничества, например, получателем.… … Справочник технического переводчика
ГОСТ Р 54135-2010: Экологический менеджмент. Руководство по применению организационных мер безопасности и оценки рисков. Защита экологических природных зон. Общие аспекты и мониторинг — Терминология ГОСТ Р 54135 2010: Экологический менеджмент. Руководство по применению организационных мер безопасности и оценки рисков. Защита экологических природных зон. Общие аспекты и мониторинг оригинал документа: 3.1 биоаккумуляция: Процесс… … Словарь-справочник терминов нормативно-технической документации
Мониторинг оксигенации головного мозга — МОНИТОРИНГ ОКСИГЕНАЦИИ ГОЛОВНОГО МОЗГА[1] является важнейшим компонентом нейромониторинга больных с внутричерепными кровоизлияниями, находящихся в критическом состоянии. К методам оценки оксигенации и метаболизма головного мозга относят:… … Википедия
Основной причиной ЦПД является нарушение метаболизма клетки. Прекращается синтез РНК клетки-хозяина, что ведёт к подавлению синтеза белков, приводит к нарушению структуры клеточных мембран, лизосом, митохондрий. Освобождаются и активируются клеточные ферменты (лизосомальные), которые вызывают деструкцию клеточных компонентов, т.е. развитие ЦПД. При резкой дегенерации клеточный монослой гибнет
К проявлению ЦПД вирусов относится образование внутриклеточных включений. Они образуются, если вирус не вызывает гибели клеток, или на стадиях до наступления гибели. Образование включений может быть единственным проявлением реакции клетки на внедрение вируса.
по типу ЦПД можно судить о семействе или роде, к которым относится исследуемый вирус:
— энтеровирусы (вирусы полиомиелита, Коксаки, ЕСНО) вызывают однородную мелкозернистую деструкцию клеток;
— аденовирусы превращают клеточный слой в скопления мелких, округлых клеток, расположенных в виде гроздьев винограда;
— парагриппозные вирусы, респираторно-синцитиальный, вирусы кори и паротита образуют симпласты.
Для идентификации выделенного вируса по нейтрализации ЦПД культуральную жидкость смешивают с равным объёмом диагностической иммунной сыворотки (разведение сыворотки 1:5 или 1:10). После 1-2-часового контакта при комнатной температуре этой смесью (по 0,2 мл) заражают 4 пробирки с культурой клеток, из которой предварительно была удалена питательная среда; после добавления смеси в пробирки вносят по 0,8 мл свежей среды. Опыт сопровождается несколькими контролями:
1 – контроль незаражённой культуры;
2 – контроль дозы вируса – клеточные культуры заражают той же дозой вируса, что и в опыте;
3 – контроль культуры, заражённой смесью культуральной жидкости с нормально сывороткой.
Опыт учитывают через 5-7 дней и более, просматривая пробирки под малым увеличением микроскопа. В первом контроле ЦПД должно отсутствовать, во втором и третьем – обязательное проявление ЦПД. Отсутствие цитопатического эффекта в опытных пробирках указывает, что в данной пробе произошла нейтрализация вируса иммунной сывороткой, сыворотка соответствует типу выделенного вируса.
Культивирование вирусов в организме лабораторных животных. Выбор экспериментальных животных определяется целью работы и видовой чувствительностью к изучаемому вирусу. Для заражения используют обезьян, кроликов, морских свинок, хомячков, белых крыс и мышей.
Лабораторных животных заражают различными способами в зависимости от тропизма вируса к определенным тканям. Так, например, для культивирования нейротропных вирусов заражение производят преимущественно в мозг (вирусы бешенства, клещевого энцефалита и др.), культивирование респираторных вирусов осуществляется при интраназальном инфицировании животных (вирусы гриппа), дерматотропных (вирус оспы) – путем накожного и внутрикожного заражения. Наиболее часто используются накожное, внутрикожное, внутримышечное, внутрибрюшинное и внутримозговое заражение.
При первичном заражении животные могут не заболеть, поэтому через 5–7 дней внешне здоровых животных убивают, а из их органов готовят суспензии, которыми заражают следующие партии животных. Эти последовательные заражения называются «пассажами».
Индикацию, т.е. обнаружение факта размножения вируса, устанавливают на основании развития типичных признаков заболевания, патоморфологических изменений органов и тканей животных или положительной реакции гемагглютинации (РГА). РГА основана на способности некоторых вирусов вызывать агглютинацию (склеивание) эритроцитов различных видов животных, птиц и человека за счет поверхностного вирусного белка – гемагглютинина.
В настоящее время использование животных для культивирования вирусов ограничено.
Культивирование вирусов в куриных эмбрионах. Большинство известных вирусов обладают способностью размножаться в курином эмбрионе (рис.56). Используют эмбрионы в возрасте от 8 до 14 дней в зависимости от вида вируса, способа заражения и задач исследования. Вирусы гриппа культивируются в 9–10-, осповакцины – в 12-, паротита – в 7-дневных куриных эмбрионах. Размножение вируса в куриных эмбрионах происходит в разных частях зародыша, что связано с особенностями тропизма вируса. Методику выращивания вируса в курином эмбрионе широко используют при промышленном культивировании.
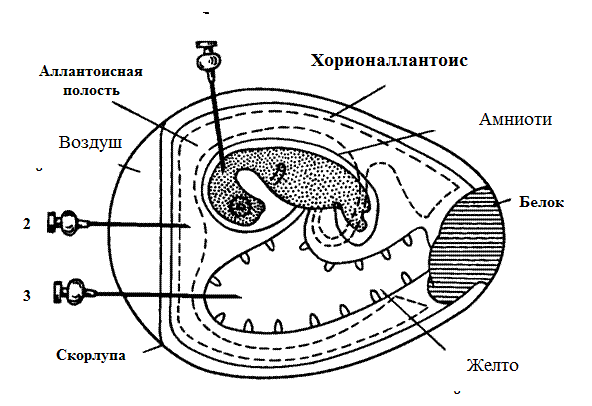
Рис. 56. Строение куриного эмбриона и способы его заражения: 1 – в амнион; 2 – в аллантоисную полость; 3 – в желточный мешок. (Микробиология и иммунология. Под редакцией Воробьева А.А. – М. – 1999).
Существует несколько способов заражения развивающегося куриного эмбриона: на хорионаллантоисную оболочку, в аллантоисную и амниотическую полости, желточный мешок, тело эмбриона.
Заражение на хорионаллантоисную оболочку применяется для выделения и культивирования вирусов, образующих на оболочках бляшки (вирусы вакцины, натуральной оспы, простого герпеса). Перед заражением яйца просвечивают с помощью овоскопа, карандашом очерчивают границу воздушного пространства и хорионаллантоисной оболочки. Поверхность яйца над воздушным пространством и в месте заражения протирают спиртом, прожигают, обрабатывают йодом и делают отверстие в полости воздушного мешка. На месте заражения скорлупу удаляют так, чтобы не повредить подскорлупную оболочку, которую затем прокалывают короткой стерильной иглой, чтобы не повредить хорионаллантоисную оболочку. Воздух из полости воздушного мешка отсасывают. Вирусный материал (0,05–0,2 мл) наносят на хорионаллантоисную оболочку туберкулиновым шприцем с короткой иглой или пастеровской пипеткой. Отверстие в скорлупе закрывают стерильным покровным стеклом или тем же выпиленным кусочком скорлупы и по краям заливают расплавленным парафином. Зараженные эмбрионы располагают на подставке горизонтально и инкубируют в термостате. Вскрытие эмбрионов производится не раньше 48 ч инкубации. На зараженной оболочке обнаруживаются беловатые непрозрачные пятна разной формы (бляшки).
Заражение в аллантоисную полость. Вирус, введенный в аллантоис, размножается в эндодермальных клетках, переходя затем в аллантоисную жидкость. Заражение осуществляют следующим способом: в скорлупе над воздушной камерой острием скальпеля или ножниц производят прокол, после чего через отверстие в вертикальном направлении вводят иглу со шприцем, которая проходит через хорионаллантоисную оболочку и попадает в аллантоисную полость, материал вводится в объеме 0,1 мл и отверстие заливают парафином.
Заражение в желточный мешок. С этой целью используют эмбрионы 5–10-дневного возраста. Наиболее употребительны два метода заражения. По первому материал вводится через воздушное пространство. В центре яйца делают отверстие, помещают его на подставку тупым концом вправо и через отверстие в вертикальном направлении вводят иглу, надетую на шприц, игла проходит через хорионаллантоисную оболочку, аллантоисную полость в желток. В желточный мешок можно ввести от 0,1 до 0,5 мл вируссодержащего материала. После заражения отверстие в скорлупе заливают парафином, и эмбрион помещают в термостат. По второму методу на границе воздушного пространства с той стороны, где лежит желток (стороны, противоположной от эмбриона), делают прокол скорлупы, через который вводят инфекционный материал. Направление иглы должно быть к центру яйца.
Индикацию вирусов в курином эмбрионе осуществляют на основании специфических поражений оболочек и тела эмбриона (оспины, кровоизлияния), а также в РГА.
Культивирование вирусов в культуре клеток. Клетки, полученные из различных органов и тканей человека, животных, птиц или других биологических объектов, способны размножаться вне организма на искусственных питательных средах в специальной лабораторной посуде («матрасы», флаконы, пробирки и др.). Большое распространение получили культуры клеток из эмбриональных и злокачественно перерожденных тканей, обладающих более активной по сравнению с нормальными клетками взрослого организма способностью к росту и размножению. В зависимости от техники приготовления различают три вида культур клеток:
1. однослойные – клетки, способные прикрепляться и размножаться на поверхности химически нейтрального стекла лабораторной посуды в виде монослоя;
2. суспензионные – клетки, размножающиеся во всем объеме питательной среды при постоянном ее перемешивании;
3. органные – цельные кусочки органов и тканей, сохраняющие исходную структуру вне организма (применяются ограничено).
По числу жизнеспособных генераций культуры клеток подразделяются на:
1. первичные, способные размножаться только на первых генерациях, т.е. в нескольких пассажах после выделения из тканей;
2. перевиваемые, или стабильные, способные размножаться в лабораторных условиях неопределенно длительный срок посредством постоянного пассирования;
3. полуперевиваемые, имеющие ограниченную продолжительность жизни (40-50 пассажей).
Приготовление первичной культуры клеток складывается из нескольких последовательных этапов: измельчение ткани, разъединение клеток путем трипсинизации, отмывание полученной однородной суспензии изолированных клеток от трипсина с последующем суспендированием клеток в питательной среде.
Перевиваемые однослойные культуры клеток приготавливают из злокачественных или нормальных линий клеток, обладающих способностью длительно размножаться in vitro в определенных условиях. К ним относятся злокачественные клетки HeLa, первоначально выделенные из карциномы шейки матки, Hep-3 (из лимфоидной карциномы), а также нормальные клетки амниона человека, почек обезьян и др.
|
| ||||
а б
Рис. 57. Индикация репродукции вируса в культуре ткани по цитопатическому действию (ЦПД): а – интактная монослойная культура клеток, б – зараженная культура (ЦПД). (Микробиология и иммунология.-Под ред. А.А. Воробьева.-М, Медицина, 1999.-464 с.)
К полуперевиваемым культурам относятся диплоидные клетки человека. Они представляют собой клеточную систему, сохраняющую в процессе 50 пассажей (до года) диплоидный набор хромосом. Диплоидные клетки человека не претерпевают злокачественного перерождения и этим выгодно отличаются от опухолевых.
Для выращивания вирусов можно использовать культуры тканей любого типа. Доза заражения зависит от цели и назначения опыта. Тканевые культуры используют для выделения новых малоизученных вирусов, когда обычным методом (заражение животных, куриных эмбрионов) невозможно установить вирусную природу возбудителя. Выбор клеточных культур определяется их чувствительностью к отдельным группам вирусов.
Различают острую и хроническую инфекции. Острое течение инфекции характеризуется цитопатическим действием (деструктивными изменениями зараженных клеток, завершающихся их гибелью). Хроническая форма репродукции вируса не вызывает быструю гибель клеток, они долгое время остаются жизнеспособными и внешне могут не отличаться от зараженных.
Индикацию вирусов в культуре клеток проводят на основании следующих феноменов:
1. Цитопатическое действие (ЦПД) – видимые под микроскопом морфологические изменения клеток, вплоть до их отторжения от стекла, которые возникают в результате внутриклеточной репродукции вирусов (рис. 57). Характер ЦПД при различных вирусных инфекциях неодинаков. При репродукции одних вирусов (парамиксовирусы, герпесвирусы) наблюдается слияние клеток с образованием синцития, других (энтеровирусы, реовирусы) – сморщивание и деструкция клеток, третьих (аденовирусы) – агрегация клеток и т.д.
2. Вирусные включения – скопление вирусных частиц или отдельных компонентов вирусов в цитоплазме или ядре клеток, выявляемые под микроскопом при специальном окрашивании. Включения различаются по величине, форме, численности. Характерные ядерные включения формируются в клетках, зараженных вирусами герпеса, аденовирусами, гриппа, бешенства, оспы и др.
3. Бляшки, или негативные колонии – ограниченные участки, состоящие из дегенеративных клеток, которые вирусы способны образовывать в монослое клеток под агаровым покрытием. Они видны невооруженным глазом как светлые пятна на фоне прижизненно окрашенных нейтральным красным клеток. Одна бляшка соответствует потомству одного вириона. Негативные колонии разных вирусов отличаются по размеру, форме. Бляшкообразование используют для дифференциации, селекции вирусов, а также для определения их концентрации в исследуемом материале. Титр вируса, установленный этим методом, выражают числом бляшкообразующих единиц (БОЕ) в 1 мл.
4. «Цветная» проба. Если вирусы не размножаются в культуре клеток, то живые клетки в процессе своего метаболизма выделяют кислые продукты, что ведет к изменению рН среды и цвета индикатора фенолового красного на желтый. При продукции вирусов нормальный метаболизм клеток нарушается, клетки гибнут, и среда сохраняет свой первоначальный (красный) цвет. Таким образом, красный цвет среды указывает на наличие вируса и прекращение жизнедеятельности клеток.
5. Гемадсорбция – способность культур клеток, инфицированных вирусами, адсорбировать на своей поверхности эритроциты определенных видов животных и птиц. Гемадсорбция проявляется скоплением в виде гроздей эритроцитов, адсорбированных на инфицированных вирусом клетках.
6. Интерференция – некоторые вирусы можно обнаружить в культуре ткани только по наличию интерференции. Испытуемый вирус вводится в культуру клеток первым, через несколько дней туда же вносят стандартную дозу вируса, обладающего выраженной цитопатической активностью или способностью вызывать гемадсорбцию. После определенного инкубирования проверяют наличие цитопатических изменений или гемадсорбции, подтверждающих размножение «выявляющего» вируса. Отсутствие в культуре «выявляющего» вируса говорит о наличии испытуемого вируса.
Индикация вирусов — Студопедия
Для выявления (индикации) вирусов применяются следующие методы.
Индикация вирусов в культуре клеток осуществляется, прежде всего, по цитопатическому действию (ЦПД) вирусов, сроки и характер которого зависят от свойств вируса, проявляясь дегенеративными изменениями клеток с последующей их гибелью и отслаиванием от стекла (рис. 29).
Полная дегенерация клеток сопровождается значительными изменениями в виде пикноза ядра и цитоплазмы, отслаиванием клеточного монослоя от стекла.
Частичная дегенерация культур клеток может протекать по следующим типам:
— гроздеобразования (округление, увеличение и слияние клеток с образованием гроздевидных скоплений, типично для аденовирусов),
— очаговой деструкции (очаги пораженных клеток на фоне в целом сохранившегося монослоя), характерной для вирусов гриппа;
— симпластообразования (слияние клеток с образованием гигантских многоядерных клеток в виде симпластов или синцитиев, характерных для вирусов кори, паротита, парагриппа, респираторно-синцитиального, герпеса, иммунодефицита человека).
Пролиферативный тип ЦПД с трансформацией клеток в злокачественные, обладающие неограниченными потенциями к росту, способны вызывать онкогенные вирусы.
Сроки, в течение которых наступает ЦПД, вариабельны (например, 1-2 дня у полиовирусов, 7-14 суток у аденовирусов).
Если в инфицированных культурах клеток ЦПД отсутствует или слабо выражено, проводят «слепые пассажи», т.е. заражают культуральной жидкостью новые культуры клеток.


А б
Рис. 29. Культура клеток почек обезьян (а – незараженная, б – цитопатическое действие вируса) х 200
Индикация вирусов с помощью реакции гемадсорбции (РГад).
Сущность этой реакции заключается в способности эритроцитов человека или животных адсорбироваться на поверхности клеток, инфицированных рядом вирусов (например, орто и парамиксовирусов и др.) в ранние сроки их репродукции (до развития ЦПД) в результате действия гемагглютининов – гликопротеидов, входящих в состав суперкапсида вируса. Для постановки РГад в культуру клеток добавляют 0,2 мл 0,5%-й взвеси эритроцитов, выдерживают 15-20 мин при температуре 40, 200 или 370 С в зависимости от свойств вируса, после чего взвесь эритроцитов удаляют и производят учет реакции под малым увеличением микроскопа по скоплению эритроцитов на отдельных клетках или на всем монослое.
Индикация вирусов по цветной пробе.
Принцип метода основан на определении кислых продуктов метаболизма, накаливающихся в клетке в процессе ее жизнедеятельности с помощью индикатора фенолового красного, меняющего свой цвет с красного в щелочной среде на оранжево-желтый в кислой среде. При заражении культуры клеток вирусами, вызывающими ЦПД (например, аденовирусы, энтеровирусы и др.), метаболизм клеток подавляется, рН среды не меняется и она остается окрашенной в красный цвет.
Индикация вирусов по внутриклеточным включениям.
Репродукция некоторых вирусов (оспы, герпеса, бешенства) приводит к образованию внутриклеточных включений, локализующихся в цитоплазме или в ядре клеток и представляющих собой скопления вируса (или его антигенов). Включения выявляют путем световой микроскопии культур клеток, окрашенных по Романовскому — Гимзе или другими методами, а также с помощью прямого флюорохромирования (например акридиновым оранжевым) с последующей микроскопией препаратов в люминесцентном микроскопе.
Индикация вирусов с помощью прямой РИФ – выявлениевирусных антигенов, находящихся в инфицированной клетке культуры ткани, с помощью антител диагностической иммунной сыворотки, специфических иммуноглобулинов или моноклональных антител, меченых флюорохромом, обычно флюоресцеином (рис. 30).
Индикация вирусов с помощью электронно-микроскопического метода (ЭММ) применяется, в основном, в научных исследованиях. Материал для ЭММ концентрируют различными методами (ультрацентрифугирование, хроматография на колонках, адсорбцией с помощью специальных сорбентов или антител – для метода иммунной электронной микроскопии). ЭММ позволяет обнаружить в ядре или цитоплазме клеток отдельные вирионы, а также их скопления. В практических целях ЭММ может быть полезен для индикации и идентификации вирусов с типичной морфологией (оспенные вирусы, ротавирусы, коронавирусы, ВИЧ и т.д.).
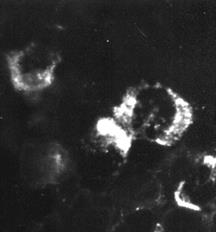
Рис. 30. Реакция иммунофлюоресценции (РИФ) – выявление вирус-специфических антигенов. х 900
Индикация вирусов по образованию бляшек — очагов разрушенных вирусом монослоя культуры клеток под агаровым покрытием. Количество бляшек отражает инфекционную активность вируса.
Для постановки этой пробы вирусную суспензию в разных разведениях вносят в культуры ткани, находящиеся в плоских сосудах, после чего монослой клеток заливают гелем (слой агара или бентонита с индикатором нейтральным красным). Время бляшкообразования для большинства вирусов, обладающих ЦПД, варьирует от 36 до 48 ч. Бляшки выглядят в виде неокрашенных светлых пятен на розово-красном фоне окрашенного монослоя. В бентонитовом методе монослой клеток молочного цвета, бляшки прозрачные.
Индикация вирусов в куриных эмбрионах.
Зараженные РКЭ инкубируют в термостате при 35- 370 С в течение 48 -72 ч., после чего производят их вскрытие, амниотическую и аллантоисную жидкость отсасывают шприцем, а оболочки и эмбрион извлекают и помещают в стерильные чашки Петри. При репродукции некоторых вирусов (натуральной оспы, осповакцины, простого герпеса) на ХАО куриных эмбрионах появляются характерные бляшки — беловатые пятна диаметром 1-2 мм, количество которых соответствует числу инфекционных частиц.
В аллантоисной и амниотической жидкости зараженных эмбрионов ряд вирусов (например, ортомиксовирусы, парамиксовирусы, аденовирусы и т.д.) может быть выявлен с помощью реакция гемагглютинации (РГА). Принцип реакции состоит в способности гемагглютининов — поверхностных вирусных структур гликопротеидной природы этих вирусов склеивать (агглютинировать) эритроциты определенных видов животных, птиц или человека. РГА не относится к иммунологическим реакциям, поскольку в ее основе отсутствует взаимодействие АГ и AT.
РГА ставят обычно в пробирках или в специальных полистироловых планшетах. Для этого готовят двукратные разведения вирусосодержащего материала на ФР в объеме 0,5 мл. Во все пробирки добавляют 0,5 мл 1% взвеси эритроцитов. В контроле к 0,5 мл ФР добавляют аналогичный объем взвеси эритроцитов. Пробы учитывают через 30-60 мин инкубации при комнатной температуре, в термостате при 370 С или в холодильнике при 40 С. Положительная реакция характеризуется выпадением осадка эритроцитов в виде «зонтика» с фестончатыми краями; при отрицательном результате эритроциты оседают в виде компактного осадка («пуговки» — рис. 31).
Гемагглютинационный титр (максимальное разведение вирусосодержащей жидкости, вызывающее агглютинацию эритроцитов — одна гемагглютинирующая единица вируса,1 ГЕ) соответствует концентрации вируса. Агглютинацию эритроцитов могут вызывать также некоторые бактерии (стафилококки, эшерихии, сальмонеллы, шигеллы, холерный вибрион Эль-Тор), что необходимо учитывать при трактовке результатов РГА при исследовании вирус-содержащего материала, загрязненного бактериальной микрофлорой.
Определение титра вирусов можно проводить также на хорионаллантоисной оболочке.Для этого в лунки стерильных полистироловых пластин помещают кусочки скорлупы 11-12-дневного куриного эмбриона с неповрежденной ХАО, добавляют вирусосодержащую жидкость в десятикратных разведениях на буфере, накрывают пластины фольгой и инкубируют при 35-37 0 С в течение 24-72 часов. После этого скорлупу удаляют, добавляют 0,5% взвесь куриных эритроцитов и производят учет реакции по эффекту гемагглютинации, который свидетельствует о репродукции вируса.
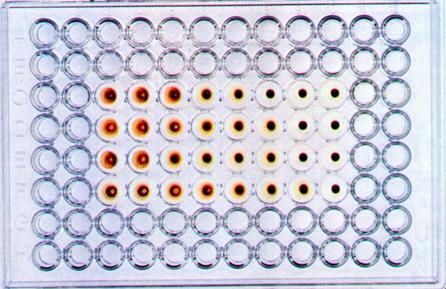
Рис. 31. Реакция гемагглютинации для выявления вируса гриппа в хорион-аллантоисной жидкости куриного эмбриона.
Индикация вирусов в организме лабораторных животных находится в зависимости от вируса и вида чувствительного лабораторного животного, будет описана в лабораторной диагностике конкретных вирусных инфекций.
Идентификация вирусов проводится с помощью следующих методов.
Учет вирусиндуцированных патологических изменений в чувствительных живых системах.
Изучение антигенных свойств вирусов в серологических реакциях с противовирусными сыворотками является основным методом идентификации вирусов. Для этого используют ряд иммунологических реакций.
Реакция нейтрализации основана на способности антител нейтрализовать инфекционную активность вирусов в культурах ткани, РКЭ, чувствительных лабораторных животных. Из вирус-содержащего материала готовят десятикратные разведения и добавляют к ним специфическую сыворотку в разведении в соответствии с титром, указанным на этикетке ампулы. Смеси вирус-сыворотка инкубируют 30 — 60 мин при 37 °С для обеспечения связывания антигенов с антителами, после чего смесью заражают культуру ткани, куриные эмбрионы или лабораторных животных. Контролем является чувствительная биосистема, зараженная вирусом без сыворотки.
Реакция считается положительной в случае нейтрализации ЦПД в культуре клеток, а также при отсутствии патологических изменений в куриных эмбрионах или в организме животных. По результатам РН высчитывается индекс нейтрализации (ИН — отношение титра вируса в контроле к титру вируса в опыте). При ИН менее 10 реакция расценивается как отрицательная, от 11 до 49 — сомнительная, от 50 и выше — положительная.
РН может быть поставлена в наиболее чувствительном варианте — подавления вирусного бляшкообразования под действием вирусспецифической антисыворотки. Для этого к вирус-содержащему материалу добавляют соответствующую искомому вирусу антисыворотку и после инкубации в термостате при 370 С течение 30-60 мин смесь вносят в культуру чувствительных клеток. Бляшкообразование выявляют в слое агара или бентонита. Идентичность вируса антителам сыворотки проявляется подавлением бляшкообразования.
Другим вариантом РН является цветная проба. Положительный результат пробы в случае соответствия вируса противовирусным антителам проявляется блокадой репродукции вируса, клетка при этом остается жизнеспособной, вырабатывая кислые продукты метаболизма, под влиянием которых цвет индикатора (фенолового красного) меняется с красного на желтый. Для постановки пробы в пробирки вносят по 0,25 мл рабочего разведения вируса и соответствующую антисыворотку.
Смесь выдерживают при комнатной температуре 30-60 мин, добавляют в каждую пробирку по 0,25 мл клеточной суспензии и закрывают их резиновыми пробками. Пробирки инкубируют в термостате при 370 С 6-8 дней, результаты реакции учитывают по изменению цвета индикатора (красный цвет индикатора соответствует щелочному характеру рН — 7,4 указывая на репродукцию вируса и подавление метаболизма клеток; желтый цвет свидетельствует о кислом рН — ниже 7,2 в результате нейтрализации вируса антителами и активном метаболизме клеток с выработкой кислых продуктов обмена).
Реакция торможения гемаггяютинации (РТГА) является одним из вариантов РН и основана на нейтрализации гемагглютинирующих свойств вирусов специфическими антителами, что проявляется отсутствием агглютинации чувствительных эритроцитов с формированием на дне пробирки или лунки полистиролового планшета компактного осадка вместо «зонтика». РТГА используется как для определения антител в качестве метода серологической диагностики, так и для идентификации вирусов, обладающих гемагглютининами. Феномен РТГА проявляется в образовании компактного осадка эритроцитов вместо «зонтика» гемагглютинации.
Перед постановкой РТГА сыворотки обрабатывают периодатом калия, каолином, бентонитом, ацетоном или другими веществами для удаления неспецифических ингибиторов гемагглютинации. После этого к двукратным разведениям сыворотки добавляют равное количество вируссодержащей жидкости с активностью 4 ГЕ, смесь инкубируют 30-60 мин при оптимальной для данного вируса температуре (40, 200, 370 С), а затем добавляют равный объем 0,5-1,0% взвеси эритроцитов. Смесь снова инкубируют 30-45 мин и производят учет результатов реакции. Титром сыворотки считают ее наибольшее разведение, которое вызывает торможение гемагглютинации.
Реакция торможения гемадсорбции (РТГадс) основана на нейтрализации эффекта адсорбции эритроцитов на поверхности клеток, инфицированных вирусами, способными вызывать гемадсорбцию. Для постановки реакции по 0,2 мл специфической сыворотки, разведенной 1:5, вносят в пробирки, инкубируют 30-60 мин в термостате при оптимальной для данного вируса температуре, затем добавляют по 0,2 мл 0,5% взвеси эритроцитов. Контрольные пробы содержат неиммунную сыворотку и эритроциты. Пробирки снова инкубируют 20-30 мин, после чего производят учет реакции. Идентификация вируса основывается на признаке отсутствия адсорбции эритроцитов на клетках в присутствии иммунной сыворотки при наличии гемадсорбции в контрольных пробирках.
Для антигенной идентификации вирусов в клетках культур тканей используются также РПГ, РСК, РИФ, РОПГА ИФА, РИА со специфическими иммунными противовирусными сыворотками или моноклональными AT.
— выявление вирусной НК методами генодиагностики с помощью метода молекулярной гибридизации и ПЦР;
— электронно-микроскопическое изучение вирусов (см. выше).

Обратная связь
ПОЗНАВАТЕЛЬНОЕ
Сила воли ведет к действию, а позитивные действия формируют позитивное отношение
Как определить диапазон голоса — ваш вокал
Как цель узнает о ваших желаниях прежде, чем вы начнете действовать. Как компании прогнозируют привычки и манипулируют ими
Целительная привычка
Как самому избавиться от обидчивости
Противоречивые взгляды на качества, присущие мужчинам
Тренинг уверенности в себе
Вкуснейший «Салат из свеклы с чесноком»
Натюрморт и его изобразительные возможности
Применение, как принимать мумие? Мумие для волос, лица, при переломах, при кровотечении и т.д.
Как научиться брать на себя ответственность
Зачем нужны границы в отношениях с детьми?
Световозвращающие элементы на детской одежде
Как победить свой возраст? Восемь уникальных способов, которые помогут достичь долголетия
Как слышать голос Бога
Классификация ожирения по ИМТ (ВОЗ)
Глава 3. Завет мужчины с женщиной

Оси и плоскости тела человека — Тело человека состоит из определенных топографических частей и участков, в которых расположены органы, мышцы, сосуды, нервы и т.д.
 Отёска стен и прирубка косяков — Когда на доме не достаёт окон и дверей, красивое высокое крыльцо ещё только в воображении, приходится подниматься с улицы в дом по трапу.
Отёска стен и прирубка косяков — Когда на доме не достаёт окон и дверей, красивое высокое крыльцо ещё только в воображении, приходится подниматься с улицы в дом по трапу.
 Дифференциальные уравнения второго порядка (модель рынка с прогнозируемыми ценами) — В простых моделях рынка спрос и предложение обычно полагают зависящими только от текущей цены на товар.
Дифференциальные уравнения второго порядка (модель рынка с прогнозируемыми ценами) — В простых моделях рынка спрос и предложение обычно полагают зависящими только от текущей цены на товар.
Индикацию, т.е. обнаружение факта размножения вируса, устанавливают на основании развития типичных признаков заболевания, патоморфологических изменений органов и тканей животных или положительной реакции гемагглютинации (РГА).
Что такое цпд? Виды цпд?
ЦПД — (цитопатическое действие вирусов) — деструктивные изменения отдельных клеток и клеточного монослоя, возникающие в результате продуктивной вирусной инфекции клеток и цитотоксического действия вирионов. В клеточном монослое ЦПД проявляется в форме сплошной или очаговой круглой или полиморфноклеточной дегенерации, образовании многоядерных клеток или клеточных симпластов, а также в пролиферативном разрастании клеток. В пораженных вирусом клетках ЦПД проявляется в пикнозе ядра, маргинации и зернистости хроматина, появлении включений, телец, кристаллов; в цитоплазме появляются вакуоли, наступает ее сморщивание и дегенерация. ЦПД используют для индикации и идентификации вирусов.
Виды: 1. Равномерная мелкозернистая деструкция клеток
(полиовирусы , вирусы Коксаки).
2. Очаговая мелкозернистая дегенерация клеток
(вирус гриппа).
З. Гроздевидная дегенерация клеток (аденовирусы).
4. Крупнозернистая равномерная деструкция клеток
(вирус герпеса).
5. симластообразование (вирус кори).
Механизм РГА и РГАдс
на поверхности эритроцитов имеются рецепторы мукопротеидной природы, способные адсорбировать вирионЫ , а на поверхности гемагглютинирующих вирусов располагаются гемагтлютинины — сложные белковые тела с энзиматической активностью. При смешивании эритроцитов с вирусосодержащей жидкостью гемагтлютинины вируса при помощи фермента муциназы вступают во взаимодействие с рецепторами эритроцитов, в результате чего происходит адсорбция вирусов на эритроцитах. Вирионы, адсорбированные на одном эритроците, способны свободными поверхностями соединяться с другими эритроцитами, образуя при этом мостики между ними, что и приводит к склеиванию (агглютинации) эритроцитов.
Адсорбция вирусов на эритроцитах является энзимэтическим процессом
ЦВЕТНАЯ РЕАКЦИЯ МЕХАНИЗМЫ
При репродукции в ткани вирусов клетки гибнут и цвет среды не меняется. Добавление специфической сыворотки нейтрализует вирус, гибель клетки не происходит и индикатор ( феноловый красный) в кислой среде меняет свой цвет с малинового на желтый. При росте клеток, не пораженных вирусом, происходит накопление кислых продуктов метаболизма что приводит к изменению рн среды и цвета индикатора
29)Метод бляшек механизм. В основе метода лежит образование в местах цитопатогенного действия вируса обесцвеченных пятен, так как пораженные клетки теряют способность сохранять или воспринимать витальные окрашивания. Пятна, или бляшки, представляют собой изолированные колонии вируса в однослойных культурах, видимые микроскопиически в виде неокрашенных округлых форм, четко выделяющиеся на фоне живых клеток, окрашенных в красный цвет.
30. Бактериофаги — бактериальные вирусы, вызывающие разрушение (лизис) бактерий и других микроорганизмов. Бактериофаги размножаются в клетках, лизируют их и переходят в др., как правило, молодые, растущие клетки. Бактериофаги состоят из головки округлой, гексагональной или палочковидной формы диаметром 45-140 нм и отростка толщиной 10-40 и длиной 100-200 нм (рис.). Другие Бактериофаги не имеют отростка; одни из них округлы, другие — нитевидны, размером 8х800 нм. Содержимое головки состоит преимущественно из РНК и небольшого количества белка. Отросток имеет вид полой трубки, окруженной чехлом, содержащим сократительные белки, подобные мышечным. У ряда Бактериофагов чехол способен сокращаться, обнажая часть стержня. На конце отростка у многих Бактериофаги имеется базальная пластинка с несколькими шиловидными или другие формы выступами. От пластинки отходят тонкие длинные нити, которые способствуют прикреплению фага к бактерии. Оболочки головки и отростка состоят из белков. Каждый Бактериофаг обладает специфическими антигенными свойствами, отличными от антигенов бактерии-хозяина и других фагов. Имеются антигены, общие для ряда фагов (особенно содержащих РНК). Некоторые фаги применяли для профилактики и лечения ряда бактериальных инфекционных болезней человека (дизентерия, брюшной тиф, холера, чума, стафилококковые и анаэробная инфекции и др.) и животных. Однако антибиотики и другие химиотерапевтические средства оказались эффективнее фагов, в связи с чем применение их с лечебной целью сузилось. Бактериофаги успешно применяются при определении вида бактерий, актиномицетов. Бактериофаги могут вредить производству антибиотиков, аминокислот, молочных продуктов, бактериальных удобрений и в других отраслях микробиологического синтеза.
31.Прионы — это белковые инфекционные частицы, имеющие вид фибрилл размером 10-20 х 200 нм, они вызывают у животных и человека энцефалопатии в условиях медленной вирусной инфекции. Вироиды — это небольшие молекулы кольцевой, суперспирализованной РНК, не содержащие белка и вызывающие заболевание растений.Прионные болезни — это группа заболеваний человека и животных, при которых происходит гибель нервных клеток головного мозга за счет накопления патологического белка (приона). Прионный белок существует в головном мозге и в норме, но при патологии он становится способным к формированию больших белковых агрегатов, мешающих работе нервной клетки. Белковые комплексы сначала накапливаются внутри клетки, а потом высвобождаются во внеклеточное пространство, где формируют «амилоидные бляшки».
32.Контаминация— попадание загрязнителей в образец или культуру;засорение (загрязнение) чистой культуры посторонними микроорганизмами. Деконтаминация—процесс уничтожения микробов в (на) каких-либо объектах. Д. осуществляют дезинфекцией или стерилизацией.Дезинфекция — комплекс мер по уничтожению патогенных микробов и резкое снижение общей микробной обсемененности материала или объекта. Стерилизация — обеспложивание, объектов, при кт уничтожаются все формы микроорганизмов. Асептика — совокупность мер, направленных на предупреждение попадания микробов в организм. Антисептика — комплекс мероприятий, направленных на уничтожение микробов в ране, патологическом очаге или организме в целом, на предупреждение или ликвидацию инфекционного воспалительного процесса.
33. Деконтаминация—процесс уничтожения микробов в (на) каких-либо объектах. Д. осуществляют дезинфекцией или стерилизацией. Цель в медицине – отрыв путей передачи, опосредованных мед.оборудованием или действиями врача, и снижение риска передачи инфекционных заболеваний.Воздействие на клеточные стенки гр+ бактерий и грибов должно состоять в разрушении оболочки из пептидогликана или хитина, так же в учете наличия в кл.стенкетейхоевых кислот. Разрушение пойдет по пептидным связям, по кислородным мостикам между гликозидными кольцами. Оболочка споры из денатурированного белка, следовательно мало нарушить структуру белка, надо разрушить вторичну структуру белка, по ковалентным связям: окислять амикислотные остатки или разрывать пептидные связи. У гр- над пептидогликановой оболочкой есть еще внешняя мембрана, где ЛПС, липопротеины и белки-порины. Необходимо определить мин.плотность необходимых нарушений хим.связей для нарушения целостности, стабильности и связаностикл.стенок. У вирусо надо не только разрушить белковую оболочку, но и уничтожить наследственную информацию. У вироидов белковой оболочки нет, только наслед.материал. Для уничтожения приона необходимо разрушить все молекулы, образующие его.
34. Физические факторы деконтаминации: температура, высушивание, фильтрование, лучистая энергия (уф и ионизирующее излучение), ультразвук, ионизированная плазма. Хим. Факторы: атибиотики, антисептики, дезинфектанты, консерванты, фенолы, галогены, спирты, ПАВ, соли тяж.металлов, красители, окислители, кислоты и щелочи, альдегиды.
35. Методы дезинфекции:
Механический, физический метод заключается в высокотемпературной обработке.Химический, биологический метод основан на использовании антагонизма различных видов микроорганизмов. Так, при использовании бактериофагов, то есть вирусов бактерий, уничтожаются стафилококки, синегнойная палочка, брюшнотифозные бактерии и т. д. Методы стерилизации: тепловая (прокаливание.Сухой жар, под давлением, текучий пар), газовая, химическая (перекись водорода, хлоргексидин, формальдегид, спирт), ультразвуком, уф и гамма-излучением, плазмой.
36.Предстерилизационная очистка предусматривает окончательное удаление остатков белковых, жировых, механических загрязнений и остаточных количеств лекарственных препаратов.Предстерилизационной очистке должны подвергаться все изделия, подлежащие стерилизации.Этапы предстерилизационной очистки: 1: промывание проточной водой после дезинфекции над раковиной в течение 30 секунд до полного уничтожения запаха дезсредств; 2: замачивание в моющем растворе при температуре воды 50°С на 15 минут шприцев и головок в разобранном состоянии; 3: мытье каждого изделия в этом же растворе, где проводилось замачивание, с помощью ерша в течение 30 секунд;4: споласкивание проточной водой; 5: споласкивание дистиллированной водой в течение 30 секунд;6: просушивание горячим воздухом при температуре +75..+87 в сушильных шкафах. Контроль качества методы: визуальный, бактериологический, химический, йодно-крахмальный. В материале после дез. И стерилиз. Должен быть хлор.
37. Автоклав: 1 атм 45 мин 1200, 2 атм 20 мин 1320. Газовый аппарат 30 мин. Р-ры хим. в-в. Ультразвук с моющим средством 15 мин. УФ и гамма-излучение 1 час. Плазмой 10-15 мин.
№38Современные методы стерилизации .контроль стерилизации.Физические методы: высокая тем.,ионизируещее излучение , фильтрование., глас- перленовый стерилизатор при тем=250гр.Комбенированные методы стерилизации:-газовая –изделия стерил от 4- 16 ч.контроль процесса ведут приборы.Плазменная стерилизация- 10 -15 мин, в зависимости от загрязнений.обьем камеры 1 л.Контроль:по показанию приборов.,с использованием физико – хим тестов.,биологические тесты, молекулярно-генетический метод контроля.( анаэробные, вирусы)
№ 39.правила техники безопасности при раб. С биоматериалом инф.ВИЧ. – заклеять открытые раны лейкопластырем.- использовать латексные перчатки однаразовые Во время работы перчатки обрабатывать 70% спиртом или другими дезинфектантами,
— мыть руки с мылом немедленно после контакта с кровью или биологическими жидкостями организма; — защищать лицо – марлевой повязкой, глаза – очками или щитком.
— обрабатывать поверхность рабочих столов, загрязненных кровью, немедленно 3% раствором хлорамина или 6% раствором перекиси водорода с 0,5% раствором моющего средства дважды с интервалом в 15 минут;
— запрещать пипетирование ртом. Засасывание в капилляры производить только с помощью резиновых груш;
— шприцы, иглы и катетеры сразу после использования помещают в специальный контейнер для дезинфекции и утилизации; — иметь на рабочем месте аптечки и достаточное количество дезинфицирующих средств.
№40. Микробный антагонизм- при котором один вид микробов угнетает развитие других, довольно широко распространен в природе.это -отношения между микроорганизмами выработались на протяжении длительного периода эволюции в борьбе за существование.
Хим факторы: Антибиотики- вещ-ва. Блокирующие ферментативный процесс в клетке,или разрушает основные ее структуры. Гликопротеиновой или протеиновая структура..Бактериоцины- в-ва, белковой природы,короткие пептидные цепочки, без ферментативной активности., действуя через специф. или неспециф. Клеточные рецепторы. Токсические продукты метаболизма- ислоты, эфиры, амины, сероводород, перекись. Формирование биопленки.
№41. Классификация антибиотиков по происхождению.1)из грибов, например рода Penicillium (пенициллин), рода Cephalosporium (цефалоспорины) 2)из актиномицетов; группа включает около 80% всех антибиотиков. Среди актиномицетов основное значение имеют представители рода Streptomyces, являющиеся продуцентами стрептомицина, эритромицина, левомицетина. 3)Антибиотики, продуцентами кт являются собственно бактерии.Bacillus и Pseudomonas,полимиксины, бацитрацины, грамицидин.4) животного происхождения; из рыбьего жира получают эктерицид, из молок рыб – экмолин, из эритроцитов – эритрин. 5) растительного происхождения. которые выделяют лук, чеснок, сосна, ель, сирень, другие растения. Антимикробным действием обладают многие растения, например, ромашка, шалфей, календула.
Вопрос 42
Бактерицидное или фунгицидное, вызывающие гибель бактерий или грибов (бета-лактамы, фторхинолоны,полиены)
Бактериостатические или фунгистатические(макролиды, тетрациклины, азолы)
Вопрос 43
Выделяют антибиотики, нарушающие синтез клеточной стенки бактерий, нарушающие структуру и синтез клеточных мембран, ингибиторы биосинтеза белка и дыхания, ингибиторы синтеза нуклеиновых кислот, процессов репликации, транскрипции и трансляции
Вопрос 45
На поверхность агаровой среды в чашке петри наносят бактериальную суспензию определённой плотности и затем помещают диски, содержащие антибиотики такой концентрации, которая обуславливает стандартный диаметр зон задержки роста чувствительных тест- бактерий. Перед посевом чашки со средой подсушивают в термостате для лучшей диффузии препаратов в пит. Среду. Каждый диск прижимают пинцетом. Диски на равном расстоянии др от др 2-2,5 см от края чашки. При помещении диска на пит среду антибиотик диффундирует в агар. Большая конц антибиот наблюдается в месте диска. Диффузия антибиотика в агар приводит к формированию зоны подавления роста микроорганизмов вокруг дисков. Чашки с посевом инкубируют в термостате 35-37гр в течение ночи. Результат учитывают путём измерения диаметра зоны торможения роста бактериальной культуры. Измерение производят циркулем или миллиметровой линейкой или спец трафаретом. При зоне задержки роста диаметром до 10мм штамм расценивается как малочувсвительный к исследуемому антибиотику; более 10мм-слабочувствительный; 10-20мм-чувствительный; более 20мм-высокочувствительный.
46.Метод серийных разведений: сущность сводится к выявлению роста исследуемой микробной культуры в ряде пробирок с питательной средой, содеджащий разные концентрации антисептиков. Этот метод определяет МПК, при кот. ингибируется рост изучаемого микроорганизма. Для разведения препаратов используют стандартные питательные среды (сердечно-мозговой бульон, рН 7,2-7,4), кот. обеспечивают оптимальные условия роста исследуемого вида и не содержат веществ, подавляющих действие антибиотиков. В приготовленные разведения препаратов вносят культуры микроорганизмов в логарифмической или ранней стационарной фазе роста. Для большинства патогенных видов бактерий этот период соответствует 16-18 часов роста. Бульонную культуру исследуемых бактерий в бульоне добавляют в объеме 1 мл к каждому разведению препарата. При э этом концентрация препарата в первом разведении становится в 2 раза ниже. Все исследования сопровождаются контролем – пробирка, содержащая 1 мл бульона и 1 мл культуры каждого испытуемого штамма без добавления препарата. После внесения микробной культуры штатив помещают в термостат и инкубируют при t= 37 C, 3-5 суток. Наличие роста микроорганизма в бульоне (помутнение бульона) свидетельствует о том, что данная кончентрация антибиотика недостаточна, чтобы подавить его жизнеспособность. По мере увеличения кнц. антиб. в руду пробиров рост микроорганизма ухудшается. МПК принято считать первую наименьшую концентрацию антибиотика, где визуально не определяется бактериальный рост.
ОСОБЕННОСТИ
n Бактерии — гаплоидные организмы, в связи с этим отсутствует явление доминантности.
n Хромосомы располагаются свободно в цитоплазме, суперспирализированы, уложены в виде кольца и прикреплены к ЦПМ.
n Передача генетического материала происходит по вертикали и горизонтали.
n Имеются внехромосомные факторы наследственности.
ОРГАНИЗАЦИЯ ГЕНЕТИЧЕСКОГО МАТЕРИАЛА У БАКТЕРИЙ
ДНК
n нуклеоид (бактериальная
хромосома): жизненно важные признаки
n внехромосомные факторы наследственности: не жизненно важные признаки
ВНЕХРОМОСОМНЫЕ ФАКТОРЫ НАСЛЕДСТВЕННОСТИ
n автономные – являются репликоном: плазмиды
n неавтономные — реплицируются только в составе репликона (нуклеоида или плазмиды): транспозоны, IS-последовательности, умеренные фаги
ВСТРАИВАНИЕ В НУКЛЕОИД ВНЕХРОМОСОМНЫХ ФАКТОРОВ НАСЛЕДСТВЕННОСТИ
n в гомологичных участках: плазмиды, умеренные фаги
n в любых участках: транспозоны, IS-последовательности
48. ПЛАЗМИДЫ-внехромосомные автономные кольцевые и суперспирализованные молекулы ДНК, размеры которых 1,5 до 200 мД
n функции
-регуляторная – компенсирует нарушение функции ДНК нуклеоида
-кодирующая – вносит в генотип новую информацию
n возможные состояния
-автономное (в цитоплазме)
-интегрированное (в нуклеоиде)
n строение
-Гены саморепликации
-Структурные гены
-Tra-оперон
n содержание tra-оперона
-Конъюгативные (трансмиссивные) плазмиды (содержат)
-неконъюгативные (мобилизируемые) плазмиды
ФУНКЦИИ TRA-ОПЕРОНА
n детерминирует образование конъюгативных пилей
n моблизирует на перенос
-саму конъюгативную плазмиду (F+)
-другую, неконъюгативную, плазмиду (RTF)
-участок нуклеоида (Hfr)
Виды плазмид и кодируемые признаки
-R-плазмиды — лекарственную устойчивость
-Col-плазмида-синтез колицинов
-Hly-плазмида –синтез гемолизинов
-Tox-плазмиды – синтез токсинов
-F-плазмида – передача генетической информации
-Плазмиды биодеградации – разрушение субстратов (белков, сахаров)
Общемедицинское значение плазмид
-Контролируют синтез факторов патогенности, в том числе у представителей нормальной микрофлоры тела человека
-Участвуют в распространении генов резистентности к химиотерапевтическим средствам и дезинфектантам, что лежит в основе формирования госпитальных штаммов
49.ТРАНСПОЗОНЫ-нуклеотидные последовательности (от 2 000 до 20 000 пар нуклеотидов), способные менять место своей локализации в молекуле ДНК и мигрировать из одной молекулы ДНК в другую
n состояние в бактериальной клетке
1. интегрированное в репликон (реплицируется вместе с ним)
2. автономное (замыкается в кольцо и не реплицируется)
n состав
1. особые концевые структуры, которые отличают транспозон от др. фрагментов ДНК (маркеры транспозона)
2. гены транспозиции
3. гены, детерминирующие синтез
-токсинов
-ферментов, обеспечивающих устойчивость к антибиотику
-белков, обеспечивающих др. признаки
Функции транспозонов
1. координация взаимодействия внехромосомных факторов наследственности между собой и с бактериальной хромосомой для обеспечения их рекомбинации
2. регуляторная (регуляция транскрипции генов путём их «включения/выключения»)
3. индукция мутаций (инверсии, дупликации на протяжении 5-9 пар нуклеотидов)
IS-ПОСЛЕДОВАТЕЛЬНОСТИ_вставки нуклеотидных последовательностей (порядка 1 000 пар нуклеотидов)
n отличия от транспозонов
1. содержат только гены транспозиции
2. не обнаружены в свободном состоянии
n функции
1. координация взаимодействия внехромосомных факторов наследственности между собой и с бактериальной хромосомой для обеспечения их рекомбинации
2. регуляторная (регуляция транскрипции генов путём их «включения/выключения»)
3. индукция мутаций (инверсии, дупликации на протяжении 5-9 пар нуклеотидов)
51.
Модификационная изменчивость вид изменчивости,которая не передается по наследству и изменения которой затрагивают лишь фенотип(.
Разлачают: 1)изменчивость,провляющаяся только при действии индуцирующего фактора.2)Сохраняющееся после действия фактора.эта делится на длительнаю,кратковременную.
Длительные-наблюдаются в течении ряда поколений после того,как индуцирующий фактор перестал действовать.
Кратковременные- сохраняются только в первых генерациях после устранения вызвавшего их фактора.
52.
Мутационная изменчивость.По происхождению: спонтанные(естественные) и индуцированные(эксперементальные). По локализации: хромосомные(несколько генов),генные,точковые.
В хромосомных выделяют: Делеции(выпадение большого кол-ва нуклеотидов),Инверсии( поворот уч-ка ДНК на 180),Дупликации(повторение уч-ка хромосомы).
Мутации,возникающие как следствие изменения в азотистых оснований в молекуле ДНК,приводят к утрате или изменению какой-либо функции.
53.
SR-диссоциация-появление в чистой культуре, образующей колоний S-формы , R-форм.
При этом изменение формы колонии является внешним проявлением изменений свойств образующих ее бактериальных клеток. У бактерий, в норме образующих R-формы колоний, также наблюдается диссоциация, которая, проявляется появлением S-форм колоний. Однако, механизм RS-диссоциации не известен и этот вид диссоциации здесь не рассматривается.
А. По своему механизму SR-диссоциация – это инсертационная мутация, приводящая к утрате генов, контролирующих синтез полисахаридных звеньев ЛПС наружной мембраны клеточной стенки. Из-за этого все свойства, функционально связанные с клеточной стенкой (форма, наличие капсулы и жгутиков, чувствительность к бактериофагам, метаболическая активность и т.д.) изменяются и как конечный результат – изменяется форма колонии.
Б. Диссоциация имеет для бактерий важное биологическое значение.
1. R-формы колоний более устойчивы к физико-химическим факторам внешней среды.
2. S-формы более устойчивы к фагоцитозу и действию антител.
В. Диссоциация значительно усложняет выделение и идентификацию чистой культуры. В этом заключается большое значение диссоциации для микробиологической диагностики.
МУТАГЕНЫ
Определение
Химические вещества или физические факторы, вызывающие предмутационные изменения в ДНК, которые в результате ошибок репарирующих ферментов или в процессе репарации переходят в мутацию.
1. Физические (УФ-излучение, R-лучи)
2. Химические (бензпирен, азид натрия, 5 бромурацил, 2 аминопурин, азотистая кислота)
3. Биологические (транспозоны, µ-бактериофаги, Is –элементы)
КЛАССИФИКАЦИЯ МУТАГЕНОВ
По механизму действия
1. аналоги азотистых оснований ð замена пар оснований
2. акридиновые красители ð выпадения или вставки оснований
3. УФ, некоторые продукты микробного метаболизма ð нарушение работы ДНК-полимеразы ð образование тиминовых димеров
4. нитрозосоединения ð множественный эффект («супермутагены»)
55 РЕПАРАЦИИ
Определение
Процесс восстановления повреждённой ДНК ферментами репарационных систем
Виды репарационных систем
n Система фотореактивации – ферменты активны в присутствии видимого света
n Система темновой репарации – ферменты действуют в темноте
Этапы репарации
n Обнаружение и надрезание поврежденного фрагмента ДНК эндонуклеазой
n Удаление вырезанного фрагмента ДНК-полимеразой 1
n Синтез нуклеотидов по матрице второй сохранившейся нити – работает ДНК-полимераза 1 и 3
n «Сшивание» восстановленного фрагмента ДНК с основной нитью за счет лигазы
56 РЕКОМБИНАЦИОННАЯ ИЗМЕНЧИВОСТЬ У БАКТЕРИЙ
Определение
Изменчивость, происходящая в результате включения в ДНК реципиентной клетки участка ДНК донорской клетки
Виды рекомбинаций
n Законная – происходит спаривание гомологичных генетических структур за счет образования водородных связей между комплементарными нуклеотидами
n Незаконная – при встраивании в любом месте ДНК бактерий транспозонов, Is — элементов
Перед выявлением вируса в клетках его обычно отделяют от клеток хозяина путем их разрушения с помощью многократного замораживания и оттаивания или растирания со стерильным песком. Полученный вирусосодержащий материал центрифугируют или пропускают через бактериальный фильтр, обрабатывают антибиотиками для предотвращения бактериального загрязнения.
Индикация (выявление) вирусов
Индикация вирусов в культуре клеток осуществляется, прежде всего, по цитопатическому действию (ЦПД) вирусов, сроки и характер которого зависят от свойств вируса, проявляясь дегенеративными изменениями клеток с последующей их гибелью и отслаиванием от стекла.
Полная дегенерация клеток сопровождается значительными изменениями в виде пикноза ядра и цитоплазмы, отслаиванием клеточного монослоя от стекла. Частичная дегенерация культур кл. может протекать по следующим типам:
гроздеобразования (округление, увеличение и слияние клеток с образованием гроздевидных скоплений, типично для аденовирусов),
очаговой деструкции (очаги пораженных клеток на фоне в целом сохранившегося монослоя), характерной для вирусов гриппа;
симпластообразования (слияние кл. с образованием гигантских многоядерных клеток в виде симпластов или синцитиев, характерных для вирусов кори, паротита, парагриппа, респираторно-синцитиального, герпеса, иммунодефицита человека).
Пролиферативный тип ЦПД с трансформацией клеток в злокачественные, обладающие неограниченными потенциями к росту, способны вызывать онкогенные вирусы.
Сроки, в течение которых наступает ЦПД, вариабельны (например, 1-2 дня у полиовирусов, 7-14 суток у аденовирусов).
Если в инфицированных культурах клеток ЦПД отсутствует или слабо выражено, проводят «слепые пассажи», т.е. заражают культуральной жидкостью новые культуры клеток.
Индикация вирусов с помощью реакции гемадсорбции (РГа).Сущность этой реакции заключается в способности эритроцитов человека или животных адсорбироваться на поверхности клеток, инфицированных рядом вирусов в ранние сроки их репродукции (до развития ЦПД) в результате действия гемагглютининов – гликопротеидов, входящих в состав суперкапсида вируса. Для постановки РГА в культуру клеток добавляют 0,2 мл 0,5%-й взвеси эритроцитов, выдерживают 15-20 мин при температуре 40, 200 или 370 С в зависимости от свойств вируса, после чего взвесь эритроцитов удаляют и производят учет реакции под малым увеличением микроскопа по скоплению эритроцитов на отдельных клетках или на всем монослое.
Индикация вирусов по внутриклеточным включениям. Репродукция некоторых вирусов (оспы, герпеса, бешенства) приводит к образованию внутриклеточных включений, локализующихся в цитоплазме или в ядре клеток и представляющих собой скопления вируса (или его антигенов). Включения выявляют путем световой микроскопии культур клеток, окрашенных по Романовскому- Гимзе или другими методами, а также с помощью прямого флюорохромирования (например акридиновым оранжевым) с последующей микроскопией препаратов в люминесцентном микроскопе.
|
|||||||||||||||||
1887
- поиск поиск
- account_circle
- Shopping_cart
- Журналы
- микробиология
- Журнал общей вирусологии
- Журнал медицинской микробиологии
- Микробная геномика
- Международный журнал систематической и эволюционной микробиологии
- Доступ Микробиология
- JMM Case Reports
- Просмотр коллекций
- О нас
- Общество микробиологии
- Зачем публиковать?
- Вступление в наши редакции
- Метрики статей и журналов
- Информация для авторов
- Подготовить статью
- Отправить статью
- Формы и шаблоны
- Тарифы открытого доступа
- Вы имеете право на бесплатный открытый доступ?
- Продвигайте свою работу
- Информация для библиотекарей
- Подписаться / получить доступ
- Лицензионные соглашения
- Управляйте своей подпиской
- Публиковать и читать
- Список публикуемых и читаемых учреждений
- Библиотека часто задаваемых вопросов
- Информация для рецензентов
- Открытый доступ
- Публикация открытого доступа в наших журналах
- Тарифы открытого доступа
- Публиковать и читать
- Политика этики
- Вопросы и ответы
- Связаться с нами
- Журналы
- Журналы
- микробиология
- Журнал общей вирусологии
- Журнал медицинской микробиологии
- Микробная геномика
- Международный журнал систематической и эволюционной микробиологии
- Access Microb
Систематическая и прикладная микробиология занимается различными аспектами микробного разнообразия и систематики прокариот. Основное внимание уделяется бактериям и археям; Эукариотические микроорганизмы будут рассматриваться только в редких случаях. Журнал понимает широкое понимание микробного разнообразия и поощряет представление рукописей из следующих разделов микробиологии:
Систематика : Теоретические и практические вопросы, касающиеся классификации и таксономии, т.е.е. (i) новые описания или пересмотры прокариотических таксонов, включая, в частности, описания еще не культивированных таксонов в категории Candidatus , (ii) инновационные методы определения таксономических и генеалогических отношений, (iii) оценка внутри-таксонов разнообразие через междисциплинарные подходы, (iv) методы идентификации.
Прикладная микробиология : полифазные исследования, объединяющие многочисленные методы, позволяющие получить подробные данные о разнообразии и функциях отдельных групп бактерий и архей во всех аспектах сельскохозяйственной, пищевой и промышленной микробиологии, включая очистку воды и сточных вод.Также эти исследования должны быть сосредоточены на прокариотической систематике.
Сравнительная биохимия и геномика : исследования, касающиеся биохимического / метаболического и геномного разнообразия культивируемых, а также некультурных бактерий и архей .
Экология : многофазные описания микробного разнообразия и состава сообществ природных и техногенных экосистем; исследования количественного определения размера, динамики и функции прокариотических популяций; инновационные исследования взаимодействия бактерий и архей друг с другом и их биотической и абиотической средой.Описание таксонов-кандидатов настоятельно рекомендуется, но должно основываться на метагеномной информации высокого качества, а также на идентификации целевых бактериальных или архейных популяций in situ.
— Elsevier
Журнал микробиологических методов публикует научные и оригинальные статьи, заметки и обзорные статьи. Эти статьи должны включать новые и / или современные методы или существенные улучшения существующих методов. Также будут опубликованы новые и инновационные приложения современных методов, которые проверены и полезны. JMM стремится к стипендии, инновациям и совершенству. Это требует научной строгости, наилучших доступных методов и технологий, правильно воспроизведенных экспериментов / тестов, включения надлежащих контролей, калибровок и правильного статистического анализа.Представление данных должно поддерживать интерпретацию метода / подхода.
Все аспекты микробиологии покрыты, кроме вирусологии. К ним относятся сельскохозяйственная микробиология, прикладная и экологическая микробиология, биологические анализы, биоинформатика, биотехнология, биохимическая микробиология, клиническая микробиология, диагностика, микробиология мониторинга и контроля качества пищевых продуктов, микробная генетика и геномика, геомикробиология, методы микробиомов независимо от среды обитания, методы секвенирования с высокой пропускной способностью и анализ, микробный патогенез и реакции хозяина, метаболомика, метагеномика, метапротеомика, микробная экология и разнообразие, микробная физиология, микробная ультраструктура, микроскопические и визуализирующие методы, молекулярная микробиология, микология, новая математическая микробиология и моделирование, паразитология, взаимодействия растений с микробами белковые маркеры / профили, протеомика, пиросеквенирование, микробиология общественного здравоохранения, радиоизотопы, применяемые в микробиологии, робототехника в микробиологических методах, микробиология рубца, микробиологические методы для космических полетов и экстремальных сред, методы отбора проб и пробоотборники, почва и седи Микробиология, транскриптомика, ветеринарная микробиология, серодиагностика и типирование / идентификация.
Редакторы, члены редколлегии и научные рецензенты — активные ученые с огромным коллективным опытом, который используется на этапах рецензирования и пересмотра статей. Мы поощряем представление предложений для научных обзоров и специальных вопросов по новым микробиологическим методам, которые имеют решающее значение для развития микробиологических знаний. Мы с нетерпением ждем ваших предложений и статей.
Преимущества для авторов
Мы также предоставляем множество преимуществ для авторов, таких как бесплатные PDF-файлы, либеральная политика в области авторского права, специальные скидки на публикации Elsevier и многое другое.Пожалуйста, нажмите здесь для получения дополнительной информации о наших услугах автора.
Пожалуйста, обратитесь к нашему Руководству для авторов за информацией о подаче статьи. Если вам нужна дополнительная информация или помощь, посетите наш Центр поддержки.
Скрыть полные цели и возможности ,Online Microbiology Notes — MicrobiologyInfo.com
Добро пожаловать на MicrobiologyInfo.com , постоянно растущий и развивающийся сборник микробиологических заметок и информации. Будь вы студент, профессор, работающий в области медицины или просто интересующийся микробиологией, я уверен, что вы найдете наши статьи интересными и информативными. Нам всегда интересно услышать, что вы хотите сказать, поэтому, пожалуйста, оставьте нам свои комментарии внизу статьи.
Пожалуйста, выберите интересную категорию из меню выше или, возможно, взгляните на наши самые популярные статьи ниже:
Об авторе — Сагар Ариал

 Меня зовут Сагар Ариал, и я страстный микробиолог и научный блогер.Я получил степень магистра в области микробиологии и в настоящее время защищаю докторскую диссертацию. из Университета Трибхуван в сотрудничестве с Институтом фармацевтических исследований им. Гельмгольца Саар (HIPS), Германия. Меня особенно интересуют исследования, связанные с актиномицетами, миксобактериями и натуральными продуктами. Вы можете узнать больше обо мне, моих полномочиях, публикациях и наградах на моем личном веб-сайте.
Меня зовут Сагар Ариал, и я страстный микробиолог и научный блогер.Я получил степень магистра в области микробиологии и в настоящее время защищаю докторскую диссертацию. из Университета Трибхуван в сотрудничестве с Институтом фармацевтических исследований им. Гельмгольца Саар (HIPS), Германия. Меня особенно интересуют исследования, связанные с актиномицетами, миксобактериями и натуральными продуктами. Вы можете узнать больше обо мне, моих полномочиях, публикациях и наградах на моем личном веб-сайте.